Tabla de contenidos
ToggleIntroducción
En la industria alimentaria, la cuantificación de microorganismos se hace esencial para determinar la calidad higiénico-sanitaria de los productos.
Si nos fijamos en la legislación vigente (Moragas & Valcárcel, 2022), vemos que siempre son los mismos los microorganismos que han de buscarse cuando hacemos un análisis en alimentos, ya sea porque son potenciales patógenos causantes de toxiinfecciones alimentarias (Salmonella, Shigella, Listeria) o porque son indicadores del estado en que ese alimento se encuentra (aerobios mesófilos, enterobacterias coliformes, E. coli, S. aureus, mohos y levaduras).
En resumidas cuentas, podemos decir que el análisis microbiológico de un alimento consiste en determinar la presencia o ausencia de estos microorganismos en dicho alimento y, en caso afirmativo, realizar su cuantificación, para posteriormente poder compararlos con los valores de referencia y poder establecer si se superan o no los máximos permitidos.
Para poder realizar un análisis completo, es necesario el uso de diferentes tipos de medios de cultivo (nutritivos, diferenciales, específicos…), de forma que consigamos el aislamiento de cada uno de los microorganismos que se han comentado anteriormente. Sin embargo, para simplificar el proceso, en la práctica que se propone a continuación se realizará la cuantificación únicamente de aerobios mesófilos, los cuales son un indicador inespecífico de la carga microbiana y nos permiten hacernos a una idea general de la conservación de ese alimento. Lo haremos de esta forma ya que para en análisis de estos nos bastará con medios de cultivo universales y acortamos en gran medida el protocolo (un análisis completo conllevaría de mucho más tiempo y es bastante más complejo), siendo por otro lado una práctica que nos permite experimentar de forma muy satisfactoria en qué consisten este tipo de análisis.
Objetivos
- Profundizar en el conocimiento de los medios de cultivo como herramienta para detectar la presencia de microorganismos en una muestra de alimentos.
- Comprender la importancia del análisis microbiológico para conocer el estado de calidad higiénico-sanitaria de los alimentos.
Capacidades terminales (CT) y criterios de evaluación (CE)
- CT 2. Analizar los distintos sistemas de conservación de alimentos precisando cuál se debe utilizar en función del tipo, grado de elaboración y destino de los mismos.
- CE C. Describir las alteraciones nutritivas que se producen en los alimentos de consumo humano por la presencia de microorganismos.
Agrupamientos
Pequeño grupo (idealmente de cinco)
Desarrollo de la práctica «análisis microbiológico de alimentos»
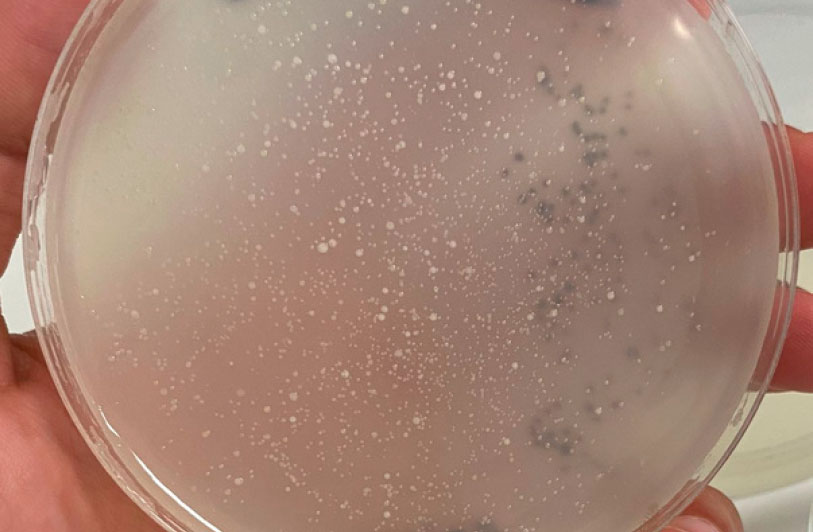
Para la realización de esta práctica tenemos que tener en cuenta que, en la mayoría de alimentos, la densidad microbiana suele ser demasiado elevada para poder realizar una siembra directa de la muestra y que esta dé buenos resultados en la cuantificación de microorganismos (para poder realizar este conteo, lo ideal es que en una placa tengamos una densidad de entre 30 – 300 colonias). Esta situación hace necesaria la dilución de la muestra de forma previa a la realización de cualquier estudio.
Además, las muestras sólidas requieren su disolución para facilitar la manipulación y permitir trabajar con ellas como si fueran muestras líquidas. Es por ello que, posteriormente a la toma de muestra y como parte del análisis, se hace una disolución primaria cuya finalidad es lograr obtener una muestra líquida y representativa del alimento.
Para realizar todo este proceso nos valdremos de la técnica de las diluciones seriadas.
Materiales
- 25/grupo placas estériles con medio de cultivo universal. Pueden comprarse ya hechas o preparar el medio de cultivo en clase siguiendo este protocolo.
- Agua de peptona tamponada ISO en polvo
- Agua destilada
- Matraz Erlenmeyer estéril
- Muestra de alimento de al menos 50g (de él se tomarán cinco muestras de 10g)
- Bisturí y hoja de bisturí estéril
- 5 bolsas de homogeneización estériles por grupo
- 30 tubos eppendorf por grupo
- Micropipetas 100-1000 µL
- 5 vidrios de reloj estériles por grupo
- 1 pipeta de 10ml estéril por grupo y pipeteador.
- Mechero de alcohol
- Asas Digralsky
- Estufa de incubación
- Rotulador permanente
- Parafilm o cinta adhesiva para sellar las placas
- Papel de filtro por puestos de trabajo
Paso previo opcional*
Si se dispone de autoclave en el taller, de forma previa al comienzo de la práctica sería interesante dedicar un primer día a preparar todo el material de vidrio, micropipetas, tubos eppendorf, etc., embalarlos de la forma adecuado y autoclavarlos para esterilizarlos.
De no ser así, es suficiente con utilizar estos materiales lo más limpios posible (siempre dejando en clase clara la importancia de la esterilidad en este tipo de análisis) a fin de intentar minimizar dentro de lo posible la contaminación, ya que el objetivo de esta práctica es simplemente que se vea como se realiza el procedimiento.
Procedimientos (1º día)
- Elaboración de las placas con el medio de cultivo nutritivo (si se decide preparar en clase)
- Preparación del agua de peptona tamponada (APT), teniendo en cuenta que serán necesarios 600 ml por grupo:
- Medir 600 ml de agua destilada
- Pesar 15,3 g de agua de peptona tamponada ISO en polvo
- Mezclar en un matraz Erlenmeyer y llevar a ebullición para esterilizar en la medida de lo posible (o autoclavar en un frasco apropiado si se dispone de autoclave) y mantener tapado de forma adecuada para preservar su esterilidad.
- Dejar que alcance una temperatura próxima a la temperatura ambiente antes de utilizarlo en los próximos pasos para no eliminar los microorganismos presentes en las muestras a analizar.
- Preparación de las disoluciones primarias
- Pesar una cantidad de 10g de la muestra a analizar, depositándolo en el vidrio de reloj estéril.
- Introducir los 10g de alimento en la bolsa de homogenización estéril (procurando mantener la esterilidad en todo momento).
- Adicionar un volumen de 90 ml de diluyente (APT).
- Homogeneizar la muestra: en los laboratorios alimentarios esto se hace con homogeneizadores, frecuentemente de paletas, que mezclan la muestra con el APT mediante golpes rítmicos a la bolsa con la mezcla. Esto desmenuza el alimento y pone los microorganismos presentes en él en suspensión. Si no disponemos de homogeneizador, desmenuzaremos el alimento con los dedos con cuidado de no romper la bolsa, y siempre manteniéndola cerrada.
- Permitir que las partículas grandes sedimenten (dejar en reposo unos 5 min).
- IMPORTANTE: por norma general en los análisis de alimentos y si nos fijamos en la normativa (Moragas & Valcárcel, 2022), para que este se considere representativo, n (número de muestras analizado) es igual a 5, por lo que cada grupo deberá procesar 5 muestras de 10 g del alimento si nuestra intención es posteriormente compararlo con los valores de referencia, ya que dicha comparación se realizará en base a los resultados obtenidos para todas ellas en su conjunto. Si vemos que la práctica se hace demasiado larga con todo esto, otra posibilidad sería dividir la clase en 5 grupos y que cada uno de ellos realice el procesamiento de cada una de esas muestras «n» para un mismo alimento, poniendo los resultados obtenidos en común para poder compararlos con los valores de referencia. En dicho caso, cada grupo solo necesitaría 5 placas de Petri, 5 tubos eppendorf, y los 600 ml de APT serían a repartir para los cinco grupos de la clase.
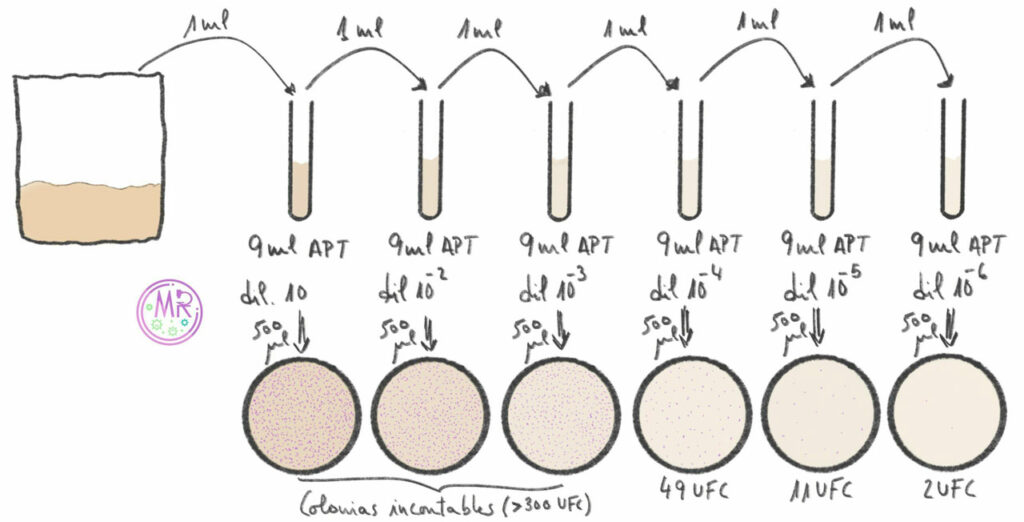
- Preparación de las diluciones seriadas
- Rotular los tubos eppendorf con las diluciones correspondientes (un total de 6) que irán desde la 10-1 a la 10-6.
- Transferir 900 µL de APT a cada uno de los eppendorf.
- Transferir una alícuota de 1 ml de la dilución primaria al tubo eppendorf rotulado como 10-1, tomando esta de las capas superiores de la suspensión, teniendo precaución para no arrastrar partículas sólidas que hayan podido quedar. El resultado es una dilución 1:10.
- Preparación dilución 1:100: tomamos 0,1 ml (100 µl) de la dilución 10-1 (previamente homogeneizada) y transferir al tubo eppendorf rotulado como 10-2.
- Preparación dilución 1:1000: tomamos 0,1 ml (100 µl) de la dilución 10-2 (previamente homogeneizada) y transferir al tubo eppendorf rotulado como 10-3.
- Preparación dilución 1:10000: tomamos 0,1 ml (100 µl) de la dilución 10-3 (previamente homogeneizada) y transferir al tubo eppendorf rotulado como 10-4.
- Preparación dilución 1:100000: tomamos 0,1 ml (100 µl) de la dilución 10-4 (previamente homogeneizada) y transferir al tubo eppendorf rotulado como 10-5.
- Preparación dilución 1:1000000: tomamos 0,1 ml (100 µl) de la dilución 10-5 (previamente homogeneizada) y transferir al tubo eppendorf rotulado como 10-6.
- Siembra en césped con el asa Drigalsky (previamente flameado para esterilizarlo antes de cada siembra) de 500 µL de cada una de las diluciones desde la 10-2 a la 10-6 (la primera dilución no suele sembrarse ya que se da por hecho que sigue estando demasiado concentrada) en sus respectivas placas, previamente rotuladas con la dilución correspondiente. Tener la precaución de asegurarnos de que la superficie de las placas están secas tras la siembra si queremos que el crecimiento bacteriano sea adecuado. De no estarlo, se debe seguir con el procedimiento hasta que lo esté.
- Incubar en la estufa a 37 ºC durante 48h.
Importante también tener en cuenta que todos estos procedimientos han de realizarse bajo mechero a fin de trabajar en un ambiente lo más estéril posible.
Procedimientos (2º día)
- Lectura de resultados: contar el número de UFC crecidas en cada placa y calcular el número de UFC/ml o UFC/g aplicando el factor de dilución correspondiente según la placa que se haya utilizado para realizar el conteo y teniendo en cuenta el volumen de alícuota sembrada en la placa.
- Comparación de los resultados con la legislación vigente para alimento analizado para determinar si supera o no los límites establecidos en cuando a aerobios mesófilos se refiere.
Evaluación
Para la evaluación de esta práctica, se tendrá en cuenta, por un lado, el desarrollo de las actividades llevadas en el taller y, por otro, la elaboración de un informe que contenga la siguiente información:
- PORTADA
- ÍNDICE
- INTRODUCCIÓN, en la que se explique qué es un análisis microbiológico de alimentos y cuál es su importancia en la industria alimentaria.
- OBJETIVOS que se pretenden conseguir con la práctica
- MATERIAL Y MÉTODOS, desde los utilizados para la realización del medio de cultivo, las diluciones y la siembra, a los empleados para el conteo y la determinación de la carga microbiana en el alimento analizado.
- RESULTADOS Y DISCUSIÓN, en el que se recojan las UFC/ml contabilizadas para cada muestra y su comparación con los valores de referencia establecidos.
- CONCLUSIÓN a la que se ha llegado respecto a la inocuidad (o no) del alimento teniendo en cuenta el grupo de microorganismos analizado.
Observaciones
La consulta de la legislación vigente para conocer los valores de referencia de un alimento puede resultar una tarea tediosa, ya que cada uno de ellos se recoge en reglamentos o reales decretos concretos. Para evitar esto, es muy interesante el documento de recopilación de normas microbiológicas de los alimentos y asimilados que actualiza prácticamente todos los años el Gobierno Vasco (Moragas & Valcárcel, 2022), en el que podemos directamente hacer la consulta por grupos de alimentos.
Referencias
Moragas, M., & Valcárcel, S. (2022). Recopilación de normas microbiológicas de los alimentos y asimilados y otros parámetros físico-químicos de interés sanitario. Recuperado el 01 de noviembre de 2023, de Euskadi.eus: https://www.euskadi.eus/contenidos/informacion/cont_alim_seg_micro/es_def/adjuntos/NORMAS-MICROBIOLOGICAS-ALIMENTOS-2022.pdf